|
| 聯亞生技營運長彭文君。(照片:擷取自國民黨直播) |
|
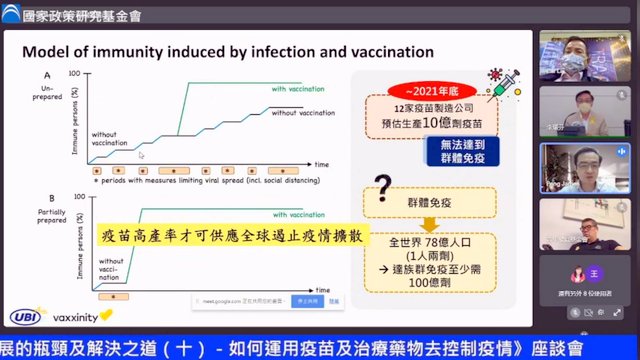
| 彭文君表示,疫苗高產率才可供應全球遏止疫情擴散。(照片:擷取自國民黨直播) |
中評社台北6月3日電(記者 張嘉文)台產疫苗聯亞生技營運長彭文君今天表示,聯亞開發疫苗現況,目前已接近EUA(緊急授權)時程,未來也有信心能獲國際認證,但在目前這空窗期中,台灣當然還是需要國際疫苗,這是齊頭並進的,並非只能等台產疫苗的問世。但目前台灣最多的AZ疫苗效果不是很好,未來長期還是看好台產疫苗。
“衛福部”疾管署已在28日與高端、聯亞兩家台產疫苗廠完成合約簽訂,每家採購500萬劑,含開口合約最多各採購1000萬劑。高端與聯亞都還在進行二期試驗。
彭文君說,日前與蔡英文視訊會議時,就是報告這進度,蔡也覺得開發順利,所以才會說7、8月台產疫苗可以供貨。彭提到,但解盲仍有風險,若失敗公司要承擔後果,目前政府與聯亞簽定的採購契約也只是訂單,如果之後EUA沒過,採購就沒有了。
中國國民黨智庫“國政基金會”今天召開《新冠肺炎疫苗發展的瓶頸及解決之道(十)-如何運用疫苗及治療藥物去控制疫情》線上座談會。由永續發展組召集人陳宜民主持,邀請智庫董事長、國民黨主席江啟臣,智庫副董事長連勝文、聯亞生技營運長彭文君、防疫學會理事長王任賢、台大公共衛生學院兼任教授金傳春、國民黨“立委”賴士葆、台北市議員游淑慧等人一同與談。
關於聯亞疫苗進度,彭文君今天在會中表示,聯亞疫苗二期試驗本月將解盲,月底申請緊急授權(EUA),盼7月通過核准、上市,預計年底量產1億劑,明年5至8億劑。
會中針對游淑慧提問聯亞疫苗是否有針對疫情影響最深的年長者,與國際疫苗仍在發展的青少年做實驗?彭文君說,聯亞疫苗有對65歲以上長者做試驗,這次解盲會一併公布結果;至於12至18歲青少年,則要等通過EUA申請後,再進一步去試驗。
至於國際認證問題,彭文君表示,台灣因為客觀條件無法允許進行三期試驗,所以目前聯亞疫苗試驗是採準三期規格,做綜合性抗體力價與安全性測試。目前全世界仍有約60億人口打不到疫苗,5月26日世界衛生組織(WHO)召開會議,討論通過二期臨床試驗疫苗與完成三期臨床試驗疫苗“免疫橋接”可能性,讓中和體評抗估可以成為一種認證標準,提升全世界疫苗供應。
彭文君表示,因此聯亞疫苗未來只要通過EUA申請,經過抗體保護力(COP)測算就可知疫苗保護力多少,他有信心聯亞疫苗品質,只要通過EUA,國際會認可,WHO也會列為準用疫苗之一。
彭文君強調,聯亞疫苗若能問世,與一般蛋白質藥物一樣在2至8度C就可儲存,不用經冷鏈,打第1劑後第29天再打兩劑即可。
外界質疑聯亞與高端等疫苗公司獲得政府超額補助一事,彭文君回應說,開發一個疫苗要十億元美金以上,台灣的廠商資本額小,必須要籌資去做,政府補貼幾億元中,買原物料的成本都不夠,政府最大的幫助是法規上支持,倒不是放水,而是滾動式審查。 |