
|
| 食藥署長吳秀梅。(截自疾管署YouTube畫面) |
|
| “衛福部”核准高端疫苗專案製造。(指揮中心提供) |

|
| 指揮中心指揮官陳時中19日表示,“衛福部”核准高端COVID-19疫苗專案製造。(指揮中心提供) |

|
| 疫情指揮中心19日下午召開疫情記者會。(截自疾管署YouTube畫面) |
中評社台北7月19日電/台產高端疫苗上周完成補件,“衛福部”食藥署昨天完成專家審查會議,通過高端新冠肺炎疫苗EUA的申請,允許專案製造。
蔡英文6月在高端疫苗第二期人體試驗尚未解盲之前,即率先宣布預計7月底可以開始供應第一波台產疫苗。
高端執行副總經理李思賢表示,拿到EUA後續將進入疫苗封緘,並根據CDC的指示交貨。針對外界關心的備貨量,高端總經理陳燦堅日前在線上記者會表示,今年底前至少有1000萬劑量產準備,明年配合國際認證會有更多的準備。目前比較緊張的是原物料非常缺,任何一項原物料缺一不可,由於全球都在搶,原物料價格持續飆漲,也是困擾。
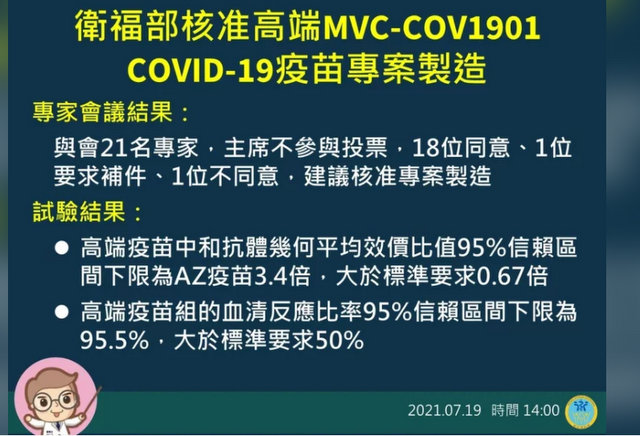
食藥署長吳秀梅今日在記者會上表示,食藥署於2021年7月18日邀請台灣化學製造管制、藥學、學、公衛、法律及醫學倫理專家召開會議,討論高端MVC-COV1901新冠肺炎專案製造申請案,經過充分的審查與討論鑑於高端疫苗的中和抗體數據已證明不劣於台灣民眾結果,中和抗體結果達成食藥署公告的新冠疫苗專製造或輸入技術性資料審查。
吳秀梅表示,在高端疫苗組AZ疫苗組,原型株活病毒中和抗體幾何平均效價比值的95%信賴區間下限為3.4倍,大於標準要求0.67倍。
吳秀梅表示,審查會議專家出席21人,其中主席不參與投票,18人同意、1人補件再議、1人不同意。
指揮官陳時中表示,這都是科學的審查結果,會盡快送到ACIP疫苗小組進行討論。
根據疾管署新聞稿:
“衛生福利部”食品藥物管理署(以下簡稱食藥署)為積極因應新型冠狀病毒疾病(以下簡稱COVID-19)疫情防疫需求,於110年7月18日邀請國內化學製造管制、藥學、毒理學、臨床醫學、公衛、法律及醫學倫理專家召開會議,討論高端MVC-COV1901新冠肺炎疫苗(以下簡稱高端疫苗)專案製造申請案。
經過一天充分的審查與討論,鑑於高端疫苗的中和抗體數據已證明不劣於國人接種AZ疫苗的中和抗體結果,達成食藥署公告之“新冠疫苗專案製造或輸入技術性資料審查基準”要求,且安全性數據顯示無重大安全疑慮:
1.高端疫苗組與AZ疫苗組之原型株活病毒中和抗體幾何平均效價比值(geometric mean titer ratio, GMTR)的95%信賴區間下限為3.4倍,遠大於標準要求0.67倍。
2.高端疫苗組的血清反應比率(sero-response rate)的95%信賴區間下限為95.5%,遠大於標準要求50%。
<nextpage>
基於疾病管制署認定國內確有疫情及疫苗緊急公共衛生需求之前提,評估整體醫療利益與風險平衡,與會專家出席21人,主席不參與投票,18人同意,1人補件再議,1人不同意。
食藥署依“藥事法第48條之2規定”,核准高端疫苗專案製造,適用於20歲以上成人之主動免疫接種,接種兩劑,間隔28天,以預防COVID-19。另針對專家會議建議,該疫苗於專案核准製造期間,藥商須每月提供安全性監測報告,並於核准後一年內檢送國內外執行疫苗保護效益(effectiveness)報告,以保障國人用藥安全。<nextpage><nextpage> |

